Zwavelzuur
| Zwavelzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van zwavelzuur
| ||||

| ||||
Molecuulmodel van zwavelzuur
| ||||

| ||||
Fles met zwavelzuur (96%)
| ||||
| Algemeen | ||||
| Molecuulformule | H2SO4 | |||
| IUPAC-naam | diwaterstofsulfaat | |||
| Andere namen | zwavel(VI)zuur, vitrioololie, vitriool | |||
| Molmassa | 98,07848 g/mol | |||
| SMILES | OS(=O)(=O)O
| |||
| InChI | 1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4)
| |||
| CAS-nummer | 7664-93-9 | |||
| EG-nummer | 231-639-5 | |||
| PubChem | 1118 | |||
| Wikidata | Q4118 | |||
| Beschrijving | Sterk zuur en zeer corrosieve, hygroscopische vloeistof | |||
| Vergelijkbaar met | zwaveligzuur, salpeterzuur, fosforzuur, chroomzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 - P264 - P280 - P363 | |||
| Hygroscopisch? | ja | |||
| Omgang | Uiterst voorzichtig behandelen, gebruik makend van zuurbestendige handschoenen en een gezichtsmasker. | |||
| Opslag | In een afgesloten glazen fles, droog en in een goed geventileerde ruimte bewaren. Gescheiden van basen, metalen en organische stoffen. | |||
| EG-Index-nummer | 016-020-00-8 | |||
| VN-nummer | 1830 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| MAC-waarde | 0,1 mg/m³ | |||
| LD50 (ratten) | (oraal) 2140[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,8356 g/cm³ | |||
| Smeltpunt | 10,38 °C | |||
| Kookpunt | 330 °C | |||
| Dampdruk | (bij 145,8°C) 1300 Pa | |||
| Goed oplosbaar in | water | |||
| Viscositeit | (bij 20°C) 0,0267 Pa·s | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−810,4097[2] kJ/mol | |||
| S |
157,2504[3] J/mol·K | |||
| Evenwichtsconstante(n) | pKa1 = −3,0[4] pKa2 = 1,99[4] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Zwavelzuur – vroeger ook wel vitriool genoemd – is een industrieel belangrijk anorganisch zuur met als brutoformule H2SO4. Onder standaardomstandigheden komt het voor als een kleurloze, geurloze, viskeuze en sterk hygroscopische vloeistof met een glasachtige glans, die volledig mengbaar is met water. Zwavelzuur wordt vrijwel altijd in de vorm van een waterige oplossing verhandeld en gebruikt.
Zwavelzuur is een van de belangrijkste universeel toegepaste grondstoffen in de chemische industrie. In 2001 werd wereldwijd bijna 165 miljoen ton geproduceerd.[5] Het voornaamste proces voor de productie van zwavelzuur is het contactproces, waarbij globaal gezien zwaveldioxide (SO2) met zuurstofgas (O2) geoxideerd wordt tot zwaveltrioxide (SO3), dat vervolgens gehydrateerd wordt. Vroeger werd het lodenkamerproces toegepast, maar daarmee kon geen sterk geconcentreerd zwavelzuur geproduceerd worden.
Een van de grootste afnemers van zwavelzuur is de kunstmeststoffenindustrie. Daarnaast wordt het toegepast als elektrolyt in loodaccu's, als (industrieel) schoonmaakmiddel, bij de synthese van sulfaatzouten, bij de raffinage van aardolie, als droogmiddel voor gassen en als reagens bij organische syntheses.
De zouten en esters van zwavelzuur worden sulfaten genoemd. In oude teksten worden de zouten ook als vitriolen aangeduid: zo verwijst kopervitriool naar koper(II)sulfaat. Tal van sulfaatzouten komen in de natuur voor in de vorm van mineralen. Enkele voorbeelden daarvan zijn calciumsulfaat (CaSO4) als gips en anhydriet, bariumsulfaat (BaSO4) als bariet, strontiumsulfaat (SrSO4) als celestien en ijzer(II)sulfaat (FeSO4) als melanteriet (dat ook ijzervitriool wordt genoemd).
De eigenschappen van zwavelzuur zijn sterk afhankelijk van de concentratie van de oplossing. In zuivere toestand is het sterk corrosief tegenover metalen, cellulair weefsel en gesteenten; een gedrag dat kan worden toegeschreven aan het sterk zure karakter van de stof, alsmede aan de dehydraterende en oxiderende aard van zwavelzuur. Om opspatten bij het maken van verdunningen te voorkomen, dient het zuur aan water te worden toegevoegd en niet omgekeerd.[6] Bij contact met de huid kunnen ernstige brandwonden ontstaan. Verder werkt zwavelzuur destructief op het hoornvlies en kan het blindheid veroorzaken.
Naamgeving en etymologie[bewerken | brontekst bewerken]
Zwavelzuur is een triviale benaming voor de stof met brutoformule H2SO4, die volgens de IUPAC-nomenclatuur diwaterstofsulfaat of dihydroxidodioxidozwavel genoemd kan worden.[7] Deze laatste benaming is volledig systematisch en in de scheikundige literatuur niet ingeburgerd.
Afhankelijk van de verdunningsgraad wordt een waterige oplossing van zwavelzuur ook nog benoemd als batterijzuur, accuzuur (verwijzend naar het gebruik als elektrolyt in een loodaccu), kamerzuur, torenzuur, gloverzuur en Engels zwavelzuur. De begrippen kamerzuur, torenzuur en gloverzuur verwijzen naar een verouderde productiemethode voor zwavelzuur, het lodenkamerproces. De term Engels zwavelzuur is afkomstig van het feit dat zwavelzuur in de 18e eeuw in grote hoeveelheden in Engeland werd geproduceerd.[8]
Vitriool en vitrioololie[9] zijn twee verouderde synoniemen voor zwavelzuur, die etymologisch teruggaan op het Latijnse vitreus (en het Laat-Latijnse vitreolus),[10] dat zoveel betekent als vervaardigd uit glas (vergelijk met het Engelse vitreous, dat 'glasachtig' betekent). Het verwijst naar de glasachtige glans die zowel zuiver zwavelzuur als de ervan afgeleide minerale verbindingen, de sulfaten, gemeenschappelijk hebben. Tegenwoordig is de benaming vitriool nog in zwang ter aanduiding van de mineralen melanteriet (een groen-geel gehydrateerd ijzersulfaat) en chalcanthiet (een blauw gehydrateerd kopersulfaat). Soms wordt vitriool nog gebruikt als synoniem voor zwavelzuur zelf, alhoewel de benaming vitrioololie een duidelijker verwijzing naar de aggregatietoestand van het zuur vormt en daarmee meer ingang als equivalente aanduiding vindt.
De zegswijze je pen in vitriool dopen betekent ‘een bijtend, zeer venijnig stuk schrijven’, en is een metaforisch verwijzing naar de bijtende eigenschappen van zwavelzuur.
Geschiedenis[bewerken | brontekst bewerken]
De oorsprong van het gebruik van zwavelzuur is omhuld met raadsels en de geschiedenis ervan is moeilijk te beschrijven, omdat er tot de 16e eeuw geen betrouwbare recepten voorhanden zijn die de bereiding van zwavelzuur beschrijven. De vroegste geschiedenis gaat uit van de ontdekking, ontginning en toepassing van sulfaathoudende mineralen.
Oudste vermeldingen[bewerken | brontekst bewerken]
De zouten van zwavelzuur, de sulfaten, waren reeds in de Oudheid bekend. Sulfaten zijn natuurlijk gevormde mineralen; tot deze groep behoren de gehydrateerde sulfaten van ijzer, koper, magnesium en zink, en zij werden onder één noemer als vitriool beschreven. De eerste vermelding van vitriool in deze betekenis komt voor in een woordenlijst van de Sumeriërs, die rond 600 v.Chr. gedateerd wordt.[11] De verschillende types vitriool werden gerangschikt naargelang de kleur die zij bezaten.
Vitriool in de Klassieke Oudheid[bewerken | brontekst bewerken]
Een van de eerste duidelijke beschrijvingen van deze mineralen is overgeleverd in het werk van de Griekse arts Pedanius Dioscorides en van de Romeinse amateur-wetenschapper Plinius de Oudere. Beide beschrijvingen dateren uit de 1e eeuw n.Chr.[11] De Romeinse arts Claudius Galenus beschreef enige medische toepassingen van de mineralen.
In het traktaat Phisica et Mystica (ca. 300 n.Chr.) van de hellenistische alchemist Zosimos van Panopolis werden enkele metallurgische toepassingen van vitriool en vitrioolachtige stoffen (zoals aluinen) beschreven. Zo werden deze mineralen onder andere gebruikt bij de zuivering van goud en bij het nabootsen van kostbare metalen.[11]
Vitriool in de Perzische alchemie[bewerken | brontekst bewerken]
De eigenschappen van vitriool waren ook bekend in de Perzische alchemie. In zijn werk Kitáb al-asrár (Boek der Geheimen), geschreven rond het jaar 900, trachtte de Perzische arts en alchemist Muhammad ibn Zakarīya Rāzi een systematische beschrijving te geven van alle minerale stoffen, zoals zij werden aangetroffen in de natuur. Hij classificeerde de stoffen in vier categorieën: mineralen, plantaardige stoffen, dierlijke stoffen en afgeleiden van de drie voorgaanden.[12] Deze laatste categorie was in feite bedoeld voor stoffen die Rāzi niet meteen kon thuisbrengen. De verschillende categorieën werden verder onderverdeeld in subcategorieën. Vitriool werd door Rāzi beschouwd als een subcategorie binnen de minerale stoffen, mogelijk duidend op het belang dat aan deze stoffen gehecht werd.[12] De subcategorie werd verder onderverdeeld in zes stoffen, waarvan er vijf nauw verwant zijn (alle vijf sulfaten van koper en ijzer die enkel van elkaar verschillen in kleur). Voorts werd ook kaliumaluminiumsulfaat, een aluin, binnen deze subcategorie geschaard. Vergelijkbare classificaties werden opgesteld door onder anderen Jabir ibn Hayyan in zijn werk Kitáb al-hawass al-kabir (8e eeuw), door Avicenna in het boek Kitáb aš-šifá (10e eeuw) en door Muhammad ibn Ibrahim al-Watwat in het traktaat Mabahig al-fihar (13e eeuw).[12]
De eerste bereidingen van zwavelzuur[bewerken | brontekst bewerken]

Via werken als De aluminibus et salibus (Over aluinen en zouten), daterend uit de 12e eeuw en van de hand van een anonieme auteur, en Liber claritas (13e eeuw) verkreeg vitriool ook in Europa bekendheid binnen de middeleeuwse alchemie. De opvallende eigenschappen, zoals de kleur van de mineralen, en de toepassingen van vitriool werden hierin uitvoerig beschreven. Het begrip vitriool wordt voor het eerst gebruikt in het 8e-eeuwse traktaat Compositiones ad tingenda, waarin diverse procedures voor de productie van kleurstoffen en pigmenten beschreven staan.[13]
Het veelvuldig experimenteren met vitriool leidde de alchemisten ertoe de bereiding van zwavelzuur te ontdekken, alsook die van salpeterzuur (door inwerking van zwavelzuur op nitraatzouten). Zij bereidden het door het roosten van ijzer(II)sulfaat (zogenaamde groene vitriool), aluin of een ander sulfaathoudend mineraal in een ijzeren retort. Referenties naar deze – toen weliswaar nog kleinschalige – bewerkingsmethode worden aangetroffen in werk van Vincent van Beauvais (13e eeuw) en in het traktaat Compositum de Compositis van Albertus Magnus.[14] Basilius Valentinus, een Duitse alchemist uit de 15e eeuw, kende verdund zwavelzuur en benoemde het als mercurius philosophorum.[8] Eerste verwijzingen naar grootschaliger productiemethoden voor zwavelzuur worden teruggevonden in De la Pirotechnia (1540), van de hand van de Italiaanse metallurg Vannoccio Biringuccio, en De re metallica (1556) van de Duitse geleerde Georgius Agricola.[13]
In de 17e eeuw werd zwavelzuur bereid door Johann Rudolph Glauber door het verhitten van zwavel en salpeter (kaliumnitraat), in de aanwezigheid van stoom. Het kaliumnitraat trad hier op als oxidator voor zwavel, waardoor zwaveltrioxide ontstond. In combinatie met stoom werd zwavelzuur gevormd:
Deze reactie werd in 1736 door de Londense apotheker Joshua Ward gebruikt om via een innovatieve methode zwavelzuur op grote schaal te bereiden. Hij voerde de reacties uit in grote glazen kolven met een volume van 230 liter, die – zowel om overdruk als verlies van zwaveldioxide en -trioxide te vermijden – een kleine opening bezaten. Kaliumnitraat diende als katalysator. Dit proces zorgde er tevens voor dat de kostprijs van zwavelzuur sterk daalde.[15]
De introductie van het lodenkamerproces[bewerken | brontekst bewerken]
In 1746 werd door John Roebuck in de Britse stad Birmingham een methode geïntroduceerd, die gebaseerd was op de oxidatiemethode van Glauber. Dit proces, het lodenkamerproces, maakte gebruik van sulfiderijke ertsen (zoals pyriet en zinkblende), die in een oven geroosterd werden tot zwaveldioxide.[16] Vanwege de corrosiviteit van de verschillende stoffen die bij het proces betrokken waren, kon het enkel in met lood beklede reactoren worden uitgevoerd. Met het lodenkamerproces, dat gedurende twee eeuwen het standaardproductieproces voor zwavelzuur vormde, konden oplossingen gemaakt worden tot hoogstens 78%. Bovendien was het zwavelzuur vaak gecontamineerd met arseen, afkomstig van de sulfide-ertsen.
Om bepaalde kleurstoffen (waaronder azokleurstoffen) te kunnen produceren waren hogere concentraties nodig. Daartoe werd een kleinschalige methode toegepast, waarbij pyriet via ijzer(II)sulfaat met zuurstofgas geoxideerd werd tot ijzer(III)sulfaat. Door dit zout te verhitten tot 480 °C trad ontleding tot ijzer(III)oxide (Fe2O3) en zwaveltrioxide op:
Dit gas werd opgelost in water om zwavelzuur te vormen. Deze procedure was een stuk omslachtiger en duurder, waardoor opschaling onmogelijk was. Dit proces stond bekend als het Vitriolbrennen.[17]
Tegen het einde van de 18e eeuw bestonden er in Groot-Brittannië vele zwavelzuurfabrieken. Alleen al in Glasgow waren dat er zes. Op het Europese continent volgden Duisburg en Rijsel eind 18e en begin 19e eeuw. De derde fabriek op het Europese vasteland was Ketjen in Amsterdam, die in 1835 nabij het Leidseplein werd opgericht als eener fabryk van vitrioololie. Tijdens het eerste jaar werd 400 ton zwavelzuur geproduceerd; in 1930 was dat al gestegen tot 15.000 ton.[15]
Het contactproces: katalysator voor de toenemende zwavelzuurproductie[bewerken | brontekst bewerken]
Begin 19e eeuw begon men zwavelzuur en het productieproces ervan ook wetenschappelijk te bestuderen. In 1831 verkreeg de Engelse azijnzuurfabrikant Peregrine Phillips een patent om met behulp van een platina-contact (katalysator) op goedkopere wijze zwavelzuur te produceren. Dit proces bleek echter niet op grote schaal toepasbaar, daar de katalysator spoedig onwerkzaam werd. Het raakte aanvankelijk in vergetelheid, maar inspanningen van diverse wetenschappers leidden tot een proces waarbij fijnverdeeld platina als katalysator gebruikt werd.[16] Deze katalysator had een veel langere levensduur, maar was tevens duur.
Vanaf 1899 werd overgegaan op vanadium(V)oxide als katalysator en daarmee is het contactproces tot op de dag van vandaag de meest toegepaste methode voor de productie van zwavelzuur.
Productie[bewerken | brontekst bewerken]
Globaal concept[bewerken | brontekst bewerken]
Alle productieprocessen van zwavelzuur zijn gebaseerd op zwaveltrioxide, een bij kamertemperatuur vloeibaar zuur oxide. In contact met water wordt zwavelzuur gevormd via een exotherme reactie (een hydrolyse):
Zwaveltrioxide is een zeer reactieve verbinding die daarom in situ bereid moet worden. Globaal gezien moeten drie stappen doorlopen worden:[18]
- De vorming van zwaveldioxide uit zwavel of een zwavelhoudende verbinding
- De oxidatie van zwaveldioxide tot zwaveltrioxide
- De omzetting van zwaveltrioxide in zwavelzuur (hydratatie)
Dit kan schematisch samengevat worden als volgt:

De vorming van zwaveldioxide[bewerken | brontekst bewerken]
Zwavel als grondstof[bewerken | brontekst bewerken]
De voornaamste grondstof voor de productie van zwavelzuur is elementair zwavel, een geurloze vaste stof met een kenmerkende gele kleur. Jaarlijks wordt er ongeveer 70 miljoen ton zwavel geproduceerd, hoofdzakelijk via het Clausproces. Een kleiner gedeelte (in 2007 was dat 800 000 ton) is afkomstig van het Frasch-proces.
Het zwavel wordt verbrand tot zwaveldioxide via een exotherme reactie (ΔHr = −297 kJ/mol):
Deze oxidatiestap grijpt plaats in een verbrandingskamer, waarin vloeibaar zwavel (150 °C) in een dunne film aangebracht wordt op de wanden. De verbrandingskamer draait met hoge snelheid (4000 tot 6000 rotaties per minuut) rond om de homogeniteit van de laag te waarborgen. In de wanden zitten talloze kleine openingen waardoor zuurstofgas geblazen wordt. De dunne film wordt geatomiseerd en vervolgens worden de zwavelatomen geoxideerd.
Sulfiden als grondstof[bewerken | brontekst bewerken]
Een alternatieve methode voor de productie van zwaveldioxide is de calcinatie van sulfidehoudende mineralen. Mineralen die daartoe in aanmerking komen zijn pyriet (een ijzersulfide), molybdeniet (een molybdeensulfide), galeniet (een loodsulfide), cattieriet (een kobaltsulfide), sfaleriet (een zinksulfide), cinnabariet (een kwiksulfide) en chalcopyriet (een sulfide van koper en ijzer). Deze worden verpulverd en in een oven sterk verhit (> 800 °C) in aanwezigheid van zuurstofgas, om verdere oxidatie tot sulfaatzouten te voorkomen. De omzetting van pyriet verloopt met vorming van ijzer(III)oxide als nevenproduct:[19]
Bij sfaleriet wordt zinkoxide gevormd:
De gevormde metaaloxiden kunnen worden gereduceerd met actieve kool of koolstofmonoxide om zuiver metaal te verkrijgen.
Naast sulfidezouten kan ook waterstofsulfide, dat vrijkomt bij het raffineren van aardgas en aardolie, worden gebruikt:
Bij deze verbrandingsreactie komt zeer veel warmte vrij: 518 kJ/mol.
Sulfaten als grondstof[bewerken | brontekst bewerken]
Sulfaten zouden rechtstreeks omgezet kunnen worden in zwavelzuur door ze te behandelen met een sterker zuur (zoals waterstofjodide). Op grote schaal is dit echter economisch niet interessant. Daarom worden de sulfaten eerst gekraakt via het zogenaamde Müller-Kühneproces. Een van de belangrijkste grondstoffen daarvoor is gips (gehydrateerd calciumsulfaat), dat eerst ontdaan wordt van kristalwater door milde verhitting. Vervolgens wordt het watervrije calciumsulfaat bij een temperatuur van 700 tot 1200 °C gereduceerd met koolstof tot calciumsulfide (CaS):
Uiteindelijk wordt het gevormde sulfide door calciumsulfaat zelf geoxideerd tot zwaveldioxide:
Calciumoxide (CaO) wordt gevormd als nevenproduct en wordt verwerkt in de cementindustrie (onder andere tot portlandcement).
De vorming van zwaveltrioxide en aansluitende hydrolyse[bewerken | brontekst bewerken]

Vervolgens moet het zwaveldioxide, dat een kleurloos gas is, nog verder geoxideerd worden tot zwaveltrioxide. Dit is een reversibele reactie die een katalysator nodig heeft. Aanvankelijk was dit platina (eerst in massieve staven, later in poedervorm), maar door de hoge kostprijs en de relatief korte levensduur van het metaal als katalysator werd vanaf 1899 overgegaan op vanadium(V)oxide (V2O5), dat aangebracht wordt op een poreuze drager (diatomeeënaarde).
Met een reactie-enthalpie van −196 kJ/mol is deze oxidatiereactie exotherm,[19] wat betekent dat er in dit proces warmte wordt vrijgegeven. Het evenwicht van de reactie kan thermodynamisch beïnvloed worden door diverse factoren:
- Het verhogen van de druk tot 5 bar (Ugine-Kuhlmannproces)
- Het verlagen van de concentratie zwaveltrioxide (dubbel contactproces)
- Het verlagen van de temperatuur (een maximale omzetting wordt bereikt rond 400 °C)
- Een overmaat zuurstofgas gebruiken
Al deze maatregelen volgen uit het principe van Le Chatelier.
Enkelvoudig en dubbel contactproces[bewerken | brontekst bewerken]
Het contactproces, dat tegenwoordig het voornaamste productieproces voor zwavelzuur is, maakt gebruik van een reactortoren met vier tot vijf plaatvormige poreuze katalysatorbedden waarop het vanadium(V)oxide (V2O5) is aangebracht.[19] Zwaveldioxide wordt bij een temperatuur van 450 °C in de reactor gebracht en op het eerste katalysatorbed verhit tot meer dan 600 °C, waarbij een omzettingsgraad van 40% behaald wordt.[19] Tussen de katalysatorbedden wordt het gasmengsel afgekoeld, om op die manier de opbrengst systematisch te verhogen. Dit proces is vergelijkbaar met een gefractioneerde destillatie.
Bij het dubbel contactproces wordt het evenwicht van de oxidatiereactie verschoven naar zwaveltrioxide door dit gas na het derde katalysatorbed weg te leiden uit de reactor. Op deze wijze wordt een hogere concentratie bereikt.
Na omzetting op het laatste katalysatorbed wordt het gas afgekoeld tot 180-200 °C en geabsorbeerd in een geconcentreerde oplossing van zwavelzuur, waardoor rokend zwavelzuur of oleum (een sterk geconcentreerde oplossing van pyrozwavelzuur) gevormd wordt:[19]
Het gevormde pyrozwavelzuur (H2S2O7) wordt uiteindelijk gehydrolyseerd tot zwavelzuur:
Zwaveltrioxide wordt dus niet rechtstreeks gehydrolyseerd met water, omdat die reactie zeer exotherm is (ΔHr = −101 kJ/mol) en aanleiding geeft tot vorming van een corrosieve aerosol van zwavelzuur.[19]
Met het dubbel contactproces kan een concentratie tot 99,8% (massafractie) bereikt worden. Bij het enkelvoudig contactproces is dat 60 tot 63%.
De katalytische cyclus[bewerken | brontekst bewerken]
Vanadium(V)oxide is de centrale katalysator bij het contactproces. Deze stof dient als zuurstofoverdragend reagens, maar is niet de enige actieve component. Er wordt een mengsel gebruikt van vanadium(V)oxide en een aantal sulfaatzouten van alkalimetalen (natrium- en kaliumsulfaat). Deze dienen als co-katalysatoren in het proces. Het mengsel vormt een actief zoutcomplex met als formule [(VO2)O(SO4)4]4−. Aan dit complex treedt eerst additie van zuurstofgas op, met vorming van [(VO2)O(SO4)4O2]4−. Vervolgens kan zuurstof geaddeerd worden aan zwaveldioxide, met vorming van zwaveltrioxide. De oxidatietoestand van vanadium blijft hierbij ongewijzigd.[20]

In de volgende stap wordt zwaveldioxide aan het zoutcomplex geaddeerd, onder vorming van [(VO2)O(SO4)4SO3]4−. Dit kan dissociëren in zwaveltrioxide en het oorspronkelijke zoutcomplex, zodat de cyclus rond is.
De temperatuur gedurende de reactiecyclus dient tussen 420 en 620 °C te liggen, omdat bij lagere temperatuur de katalysator omgezet wordt tot een vanadium(IV)-zout. Dit is niet actief in het katalytisch proces en kan bij verhoging van de temperatuur ontleden:[20]

Terugwinning[bewerken | brontekst bewerken]
Om economische redenen wordt zwavelzuur dat niet al te sterk verontreinigd is, steeds meer teruggewonnen. Dit gebeurt onder andere door het zwavelzuur bij een temperatuur van 340 °C over te destilleren. Via die methode kan ongeveer 95% van het zwavelzuur teruggewonnen worden.[21]
Zwavelzuur dat sterk verontreinigd is, komt als zodanig niet voor hergebruik in aanmerking, maar wordt eerst thermisch ontleed. Daartoe wordt het zwavelzuur in een reactor gebracht en verhit tot 1000 °C, zodat opnieuw zwaveldioxide gevormd wordt:[22]
Het zo ontstane zwaveldioxide kan vervolgens door middel van het contactproces opnieuw omgezet worden in zwavelzuur. Het rendement van dit proces bedraagt ongeveer 99,95%.
Typische verontreinigingen die voorkomen in gebruikt zwavelzuur, zijn silicium en metalen (natrium, kalium, aluminium, calcium, ijzer, chroom, nikkel en koper).[21]
Overige methoden[bewerken | brontekst bewerken]
Naast de industriële productiemethoden zijn er ook methoden die toegesneden zijn op productie van zwavelzuur op kleinere schaal. Een in het laboratorium toegepaste methode is de reactie van kaliummetabisulfiet (K2S2O5) met geconcentreerd zoutzuur (HCl):
Deze reactie produceert zwaveldioxide, dat geborreld wordt door een waterige oplossing van waterstofperoxide (H2O2), zodat in situ zwavelzuur gevormd wordt:
De oplossing moet continu gekoeld worden met ijs omdat de reactie zeer veel warmte genereert. Vervolgens wordt de oplossing geconcentreerd door ze te verhitten boven 100 °C.
De Bunsen-reactie maakt gebruik van zwaveldioxide en di-jood in water om een mengsel van zwavelzuur en waterstofjodide te bekomen. Dit is echter geen praktische methode, omdat verdere scheidingsprocedures nodig zijn om de zuren te isoleren.
Vroeger werd het lodenkamerproces gebruikt bij de zwavelzuurproductie, maar dit is in verval geraakt omdat geen hoge concentraties konden behaald worden. Bovendien was het zwavelzuur niet zelden gecontamineerd met arseen.
Structuur en bindingseigenschappen[bewerken | brontekst bewerken]
In de gasfase bestaat zwavelzuur uit individuele moleculen, die opgebouwd zijn rond zwavel als centraal element. Doordat zwavel hier gebonden is aan 4 zuurstofatomen, bevindt het zich in een hoge oxidatietoestand (+VI). Twee van de zuurstofatomen zijn dubbel gebonden, de andere twee bezitten elk nog een waterstofatoom. Het molecuul bezit rond zwavel een tetraëdrische moleculaire geometrie. De O-S-O-bindingshoeken bedragen 123,3° en de S-O-H-hoeken meten 101,3°. De dubbelgebonden zuurstofatomen genereren een kortere bindingslengte (142,2 pm) dan de enkelvoudig gebonden (157,4 pm).[23]
De bindingen in zwavelzuur (A) zijn niet statisch en het molecuul kan door diverse resonantiestructuren weergegeven worden. Een van die resonantiestructuren (B) herleidt de moleculen tot een structuur waarin de oorspronkelijk dubbelgebonden zuurstofatomen enkelgebonden en negatief geladen worden. Het zwavelatoom wordt tweevoudig positief geladen:

Theoretische berekeningen[24] laten zien dat de d-orbitalen op zwavel, die conform de molecuulorbitaaltheorie nodig zijn voor het beschrijven van de zwavel-zuurstofbindingen, eigenlijk weinig bijdragen aan het bindingsfenomeen in zwavelzuur. Daarom is het theoretisch gezien beter om de structuurformule te beschrijven met resonantiestructuur B. De kortere bindingslengte van de oorspronkelijke dubbele bindingen kan in die resonantiestructuur verklaard worden door de elektrostatische wisselwerking (coulombkracht) die zich tussen de formele ladingen in het molecuul manifesteert. Vergelijkbare situaties doen zich voor bij zwaveligzuur en fosforzuur.[24]
Fysische eigenschappen[bewerken | brontekst bewerken]

Zwavelzuur in vloeibare en gasvormige toestand[bewerken | brontekst bewerken]
In zuivere toestand komt zwavelzuur voor als een kleurloze vloeistof, die bij ongeveer 10,4 °C uitkristalliseert. De kleur van zwavelzuur kan soms sterk verschillen: in onzuivere toestand verkleurt het geel tot geel-bruin door de aanwezigheid van verontreinigingen en ontledingsproducten (zwaveloxiden). Het technisch verhandelde product, bijvoorbeeld in de vorm van krachtige (gootsteen)ontstopper, is doorgaans gekleurd met een kleurstof.
Het kookpunt van zwavelzuur is niet eenduidig te bepalen, omdat reeds vanaf 279 °C zwavelzuurdampen gevormd worden (die een karakteristieke witte kleur hebben door reactie met waterdamp in de lucht) en omdat vanaf 300 °C traag ontleding optreedt (pas boven 340 °C wordt dit significanter). Bij een temperatuur van 338 °C bereikt de zwavelzuurdamp een zuurgehalte van 98% en daarmee ook het azeotroop punt met water. Bij verdere verhitting treedt ontleding tot zwaveltrioxide en water op:
Deze reactie is vanaf 450 °C volledig aflopend: zwavelzuur is dan als het ware volledig gedissocieerd.
Tussen de zwavelzuurmoleculen zijn sterke waterstofbruginteracties werkzaam. Zij vormen een verklaring voor het hoge kookpunt (330 °C) en voor de relatief hoge viscositeit van de zuivere vloeistof: die bedraagt bij 25 °C 24,6 mPa·s. Ter vergelijking: de viscositeit van water bedraagt bij die temperatuur slechts 0,89 mPa·s, ongeveer 28 keer lager. Net als bij alle vloeistoffen neemt de viscositeit van zwavelzuur af met toenemende temperatuur.
Zwavelzuur in vaste toestand[bewerken | brontekst bewerken]
Watervrij zwavelzuur kristalliseert uit in een monoklien kristalstelsel en behoort tot de ruimtegroep C2/c. De parameters van de eenheidscel bedragen:[25]
- a = 814 pm
- b = 470 pm
- c = 854 pm
- β = 111°
Ook enkele kristallijne hydraten zijn bekend. Het dihydraat (H2SO4 · 2 H2O) is eveneens monoklien en behoort tot ruimtegroep C2/c. De dimensies van de eenheidscel bedragen:[26]
- a = 1300,8 pm
- b = 797,9 pm
- c = 1488,1 pm
- β = 101,60°
De structuur van dit hydraatkristal moet opgevat worden als bestaande uit H3O+- en SO42−-ionen, die met elkaar verbonden zijn door waterstofbruggen.
Waterige oplossingen van zwavelzuur[bewerken | brontekst bewerken]
Zwavelzuur is polair en dus in alle verhoudingen mengbaar met water. De concentratie van een waterige oplossing van zwavelzuur wordt standaard uitgedrukt als een massafractie. Hoewel met het dubbel contactproces een concentratie van 99% en hoger bereikt kan worden, bezit de sterkst geconcentreerde oplossing een massafractie van 98,3%. In termen van molaire concentratie komt dit overeen met ongeveer 18 mol zwavelzuur per liter. De reden dat een hogere concentratie niet bereikt kan worden vloeit enerzijds voort uit het verlies aan opgelost, maar niet-gereageerd zwaveltrioxide bij verhitting van de vloeistof en anderzijds uit het thermodynamisch gedrag van het binair vloeistofmengsel: water en zwavelzuur vormen een azeotroop met elkaar. De 98%-oplossing wordt daarom ook wel geconcentreerd zwavelzuur genoemd; het is een viskeuze olieachtige vloeistof, die om die reden vroeger vaak vitrioololie werd genoemd.[9] De diverse mengsels met water, die soms een alternatieve benaming wordt toebedeeld (verwijzend naar hun toepassing of de gebruikte productiemethode), worden opgesomd in de onderstaande tabel:[27]
| Massafractie H2SO4 |
Dichtheid (kg/L) |
Molaire concentratie (mol/L) |
Alternatieve benaming(en) |
|---|---|---|---|
| 10% | 1,07 | ± 1 | verdund zwavelzuur |
| 29–32% | 1,25 – 1,28 | 4,2 – 5 | batterijzuur accuzuur |
| 62–70% | 1,52 – 1,60 | 9,6 – 11,5 | kamerzuur |
| 78–80% | 1,70 – 1,73 | 13,5 – 14 | torenzuur gloverzuur |
| 98,3% | 1,83 | ± 18 | geconcentreerd zwavelzuur vitrioololie |
Door de toenemende hoeveelheid zwavelzuur neemt ook de dichtheid van de oplossingen toe. Bij het maken van verdunningen dient het zuur steeds aan water te worden toegevoegd: het contact tussen zwavelzuur en water is namelijk dermate exotherm dat de temperatuur gemakkelijk tot 80 °C kan oplopen.[9] Daarbij kan de vloeistof opspatten, hetgeen een onveilige situatie creëert.
Zwavelzuurhydraten[bewerken | brontekst bewerken]
Zwavelzuur komt in verschillende hydraten voor: bekend zijn onder andere het dihydraat (H2SO4 · 2 H2O), het tetrahydraat (H2SO4 · 4 H2O), het hemihexahydraat (H2SO4 · 6½ H2O) en het octahydraat (H2SO4 · 8 H2O). Er zijn echter ook andere hydraten bekend, maar hun voorkomen hangt af van het gewichtspercentage van de waterige oplossing.[28] Het smeltpunt van de hydraten neemt af met toenemende hydratatiegraad. Zo smelt het monohydraat bij 8,59 °C, terwijl het octahydraat reeds bij −62 °C overgaat naar de vloeistoffase.[29]
Polariteit en geleidend vermogen[bewerken | brontekst bewerken]
Watervrij zwavelzuur is een zeer polaire verbinding en bezit een diëlektrische constante εr van ongeveer 100 (ter vergelijking: die van water bedraagt 78,5). De stof bezit ook een zekere elektrische geleidbaarheid, waarvan de oorzaak moet gezocht worden in de structuur en chemische eigenschappen van de molecule. Zwavelzuur is namelijk in staat om zichzelf te protoneren, een proces dat bekendstaat als autoprotolyse:
De soortelijke geleidbaarheid σ van zwavelzuur bedraagt 1,044 × 10−2 S/cm.[30] Bij 25 °C bedraagt de waarde van de evenwichtsconstante Kap van de autoprotolyse 2,7 × 10−4 en zij wordt gedefinieerd als:
Ter vergelijking met de autoprotolyse van water: de evenwichtsconstante voor het waterevenwicht bedraagt slechts 1 × 10−14, ongeveer een factor 10 miljard lager. Dit alles maakt dat zwavelzuur de elektrische stroom gemakkelijk geleidt en bijgevolg ook een prima oplosmiddel voor bepaalde reacties vormt.
Chemische eigenschappen en reacties[bewerken | brontekst bewerken]
Reactie met water en dehydraterende eigenschappen[bewerken | brontekst bewerken]

Wanneer zwavelzuur wordt gemengd met water (om het te verdunnen), treedt een exotherm proces op (waterdamp wordt gevormd, hetgeen wijst op een sterke temperatuurstoename). Dit illustreert de sterk hygroscopische aard van het zuur. Indien water op geconcentreerd zwavelzuur wordt gegoten, kan het mengsel opspatten; daarom dient zwavelzuur steeds aan water te worden toegevoegd en niet omgekeerd. Dit heeft een chemische achtergrond: de reactie die optreedt tussen zwavelzuur en water is een evenwichtsreactie, die in het voordeel van de protonering van water uitvalt (zwavelzuur is immers het sterkste zuur van beide componenten). Door het zuur aan water toe te voegen, is zwavelzuur het beperkend reagens in de reactie en is de exothermiciteit ervan veel minder uitgesproken. Desalniettemin kan nog steeds een significante temperatuurstijging waargenomen worden.
De reactie met water treedt, aangezien zwavelzuur over twee zure waterstofatomen beschikt (het is dus een diprotisch zuur), op in twee fasen. De eerste fase is een aflopende reactie met vorming van het waterstofsulfaatanion (HSO4−):
De evenwichtsconstante van deze eerste reactie bedraagt 2,4 × 106. Deze waarde is dusdanig groot dat er eigenlijk geen sprake is van een echt evenwicht. Voor de tweede fase van het proces is de evenwichtsconstante een stuk kleiner (1,0 × 10−2), waardoor dit wel een echte evenwichtsreactie is:
De lagere waarde voor de evenwichtsconstante vindt haar oorsprong in de lagere aciditeit van het waterstofsulfaatanion (dat ook wel als bisulfaat aangeduid wordt) en de zwakke basiciteit van het gevormde sulfaatanion (SO42−).
Het mengen van water met zwavelzuur leidt tot het verkleinen van het volume van de resulterende oplossing.[31]
Dehydratie van organische verbindingen[bewerken | brontekst bewerken]
Geconcentreerd zwavelzuur is dermate hygroscopisch dat het in staat is om water te onttrekken aan talrijke organische stoffen, niet in het minst suikers en aanverwante (polysachariden), zoals hieronder geïllustreerd wordt:

De reactievergelijking voor dit proces met sacharose (tafelsuiker) als organische verbinding wordt gegeven door:
De reactie-enthalpie bedraagt −918,9 kJ/mol, hetgeen aangeeft dat het een zeer sterk exotherm proces betreft.[32] Aanvankelijk treedt – als gevolg van de warmteontwikkeling – eerst karamellisatie van de suiker op, hetgeen resulteert in een geel-bruine kleur van het mengsel en een typische zoete geur. Pas in een later stadium wordt de reactie heviger.
Op gelijkaardige wijze treedt reactie op tussen zwavelzuur en zetmeel of cellulose (die uit koolhydraatpolymeren bestaat). Aangezien dit laatste de hoofdcomponent van tissues en katoen is, leidt ieder contact van deze materialen met zwavelzuur tot degradatie ervan. De algemene reactievergelijking voor dit proces wordt gegeven door (waarbij n het aantal monomere suikereenheden in zetmeel of cellulose voorstelt):
Dehydratie van zouthydraten[bewerken | brontekst bewerken]
Het dehydraterend karakter van zwavelzuur kan ook geïllustreerd worden door de reactie ervan met zouthydraten. Zo wordt het kristalwater van koper(II)sulfaatpentahydraat (een blauwe kristallijne vaste stof) aan de stof onttrokken, waardoor watervrij koper(II)sulfaat (een witte kristallijne vaste stof) overblijft:
Zelfontwatering[bewerken | brontekst bewerken]
Een verder bewijs voor de hoge hygroscopiciteit van zwavelzuur is het optreden (weliswaar in geringe mate) van zelfontwatering:
Zuur-base-eigenschappen[bewerken | brontekst bewerken]
Protolysereacties[bewerken | brontekst bewerken]
Zwavelzuur is het prototype van een sterk anorganisch zuur: het staat zeer gemakkelijk protonen af aan deeltjes die als protonacceptor (base) kunnen optreden zoals water, alcoholen en amines. Aangezien zwavelzuur twee protonen ter beschikking heeft, treden (in verdunde waterige oplossing) twee protolysereacties op, elk gekenmerkt door een zuurconstante (pKa). De eerste protolyse is sterk aflopend en heeft een pKa-waarde van −3,0:[4]
Het is deze protolysestap die van zwavelzuur een sterk zuur maakt. Het gevormde waterstofsulfaat is een veel minder sterk zuur en dat uit zich in een hogere pKa-waarde (1,99):[4]
Op basis hiervan is het mogelijk om te bepalen dat een verdunde oplossing van zwavelzuur in water (met een concentratie van ongeveer 1 mol/L) voor het grootste gedeelte bestaat uit waterstofsulfaationen en dat zwavelzuur voor 100% gedissocieerd is. De tweede protolysestap, waarbij sulfaat gevormd wordt, vindt bij die concentratie slechts voor 1,3% plaats.[29] Bij sterkere verdunningen verschuift het evenwicht van die reactie naar rechts en wordt dus proportioneel meer sulfaat gevormd.
Hoewel zwavelzuur zelf geen superzuur is, wordt het wel gebruikt als maatstaf om superzuren te definiëren: ieder zuur dat sterker is dan 100% zuiver zwavelzuur, wordt als superzuur bestempeld. Dit houdt in dat een superzuur, zoals trifluormethaansulfonzuur, in staat is om zuiver zwavelzuur te protoneren. Daarbij worden zouten met het H3SO4+-ion gevormd.
Reacties met basen[bewerken | brontekst bewerken]
Zwavelzuur reageert met basen, onder vorming van zouten (meestal sulfaatzouten). Zo kan bijvoorbeeld koper(II)sulfaat gevormd worden door de reactie met koper(II)oxide:
Verder is zwavelzuur in staat om zwakkere zuren uit hun basische zouten te verdrijven. De reactie met natriumacetaat levert bijgevolg azijnzuur op:
Als nevenproduct wordt hier natriumwaterstofsulfaat gevormd, dat een zuur zout is.
De reactie met kaliumnitraat levert salpeterzuur, dat met een pKa-waarde van −1,44 ook een vrij sterk zuur is:
Deze reactie was reeds in de 17e eeuw bekend.
Met carbonaten en waterstofcarbonaten wordt koolstofdioxide vrijgesteld. Als voorbeeld kan de omzetting van natriumcarbonaat tot natriumsulfaat gelden:
Reacties met metalen[bewerken | brontekst bewerken]
Aangezien zwavelzuur sterk oxiderende eigenschappen bezit, reageert het met reductoren zoals metalen. De verdunningsgraad van het zuur speelt hierbij een prominente rol: verdund zwavelzuur zal veel heviger reageren met bepaalde metalen dan geconcentreerd zwavelzuur. De oorzaak hiervoor ligt bij de passivering van het metaal: het bouwt een oxidelaag op, die verdere aantasting door het zuur belemmert. Metalen waarbij dit optreedt zijn lood en wolfraam.
Verdund zwavelzuur reageert doorgaans hevig met makkelijk oxideerbare metalen, onder vorming van waterstofgas en metaalzouten (sulfaten). Typische reactieve metalen zijn ijzer, aluminium, zink, mangaan, magnesium en nikkel. Zo wordt bij reactie met ijzer ijzer(II)sulfaat gevormd:
Geconcentreerd zwavelzuur reageert op een alternatieve manier. Het is zodanig oxiderend dat er geen waterstofgas, maar zwaveldioxide en sulfaationen gevormd worden:
De elektronen (e−) worden afgestaan door het metaal.
De snelheid waarmee de oxidatie verloopt is ook afhankelijk van de standaardredoxpotentiaal: een sterk negatieve waarde indiceert een vlotte oxidatie, terwijl een positieve waarde duidt op een moeizaam oxidatieproces. In de onderstaande afbeelding wordt een overzicht gegeven van enkele metalen in verdund zwavelzuur, gerangschikt volgens hun standaardredoxpotentiaal:

Aluminium, met een standaardredoxpotentiaal van −1,662 V, reageert traag (hoewel dit metaal thermodynamisch gezien het gemakkelijkst geoxideerd wordt). Zink (−0,763 V) en ijzer (−0,447 V) reageren beide snel: de instantane vorming van waterstofgas is hiervoor een indicatie. Daarnaast wordt ook een bepaalde hoeveelheid warmte gegenereerd. Lood (−0,126 V) treedt passiverend op en zal dus niet geoxideerd worden. Koper, dat een positieve standaardredoxpotentiaal bezit (0,345 V), wordt enkel in warm zwavelzuur gemakkelijk geoxideerd:[33]
Ook bij zilver, tin en kwik treedt dit verschijnsel op.
Reacties met niet-metalen[bewerken | brontekst bewerken]
Met niet-metalen zijn weinig reacties bekend. Zwavelzuur reageert enkel met koolstof en zwavel bij hogere temperaturen en werkt daarbij zuiver oxiderend (met vorming van respectievelijk koolstofdioxide en zwaveldioxide):
Reacties met halogenidezouten[bewerken | brontekst bewerken]
Zwavelzuur reageert met bepaalde halogenidezouten, onder vrijstelling van waterstofhalogeniden. Zo wordt waterstofchloride gevormd door reactie met natriumchloride:
Met fluoriden, zoals calciumfluoride, wordt waterstoffluoride gevormd:
Deze laatste reactie is ook de belangrijkste industriële productiemethode van het zuur. Met bromiden of jodiden is deze reactie niet mogelijk, omdat zwavelzuur het bromide- en jodide-ion oxideert tot respectievelijk dibroom en di-jood.[34]
Reacties in de organische chemie[bewerken | brontekst bewerken]
Elektrofiele aromatische substituties[bewerken | brontekst bewerken]
In combinatie met salpeterzuur wordt nitreerzuur gevormd, dat het reactieve nitroniumion (NO2+) bevat:
Dit reagens wordt gebruikt om aromatische verbindingen te nitreren in het proces dat bekendstaat als de elektrofiele aromatische substitutie. Een voorbeeld is de nitrering van benzeen:

Zo kunnen TNT en picrinezuur, beide schokgevoelige stoffen, worden bereid door de nitrering van respectievelijk tolueen en fenol.
Daarnaast wordt zwavelzuur, waarin zwaveltrioxide is opgelost (oleum), gebruikt bij de sulfonering van aromaten. Zo kan benzeen omgezet worden tot benzeensulfonzuur:

Aangezien de aromatische sulfonering een evenwichtsreactie is, zijn doorgaans vrij krachtige reactieomstandigheden nodig (hoge temperatuur, lange reactietijd, geconcentreerd zwavelzuur) om de reactie volledig te laten verlopen. Dit beperkt de toepasbaarheid van de reactie, omdat tal van organische verbindingen onder die omstandigheden kunnen ontleden of degraderen.
Zure katalysator[bewerken | brontekst bewerken]
Zwavelzuur kan gebruikt worden als katalysator bij een aantal organische reacties, zoals een verestering (met name de Fischer-verestering) of een acetalisering. Bij het cumeenproces, waarbij fenol en cumeen gevormd worden uit benzeen en propeen, wordt zwavelzuur gebruikt om in een laatste stap het intermediair gevormde cumeenhydroperoxide te splitsen in fenol en aceton:

Overige reacties die gebruikmaken van zwavelzuur zijn onder andere de Koch-reactie, de Lehmsted-Tanasescu-reactie, de Nef-reactie en de Ritter-reactie.
Toepassingen[bewerken | brontekst bewerken]
Van alle bulkchemicaliën is zwavelzuur de meest geproduceerde en meest toegepaste. De nationale productie van zwavelzuur vormt – naast die van chloorgas – doorgaans een goede indicator voor de industriële ontwikkelingsgraad van een land.[35] In 2012 bedroeg de mondiale productie ongeveer 250 miljoen ton, waarvan 34% in China, 13,6% in de Verenigde Staten, 5% in India, 5% in Rusland en 3,4% in Marokko werd geproduceerd.[36]
Algemeen[bewerken | brontekst bewerken]

Circa 60% van het geproduceerde zwavelzuur wordt gebruikt in de kunstmestindustrie, meer bepaald voor de fabricage van superfosfaat, ammoniumfosfaat en ammoniumsulfaat.[37] Ongeveer 15% wordt afgenomen door de chemische industrie, waar het ingezet wordt bij de productie van detergenten, synthetische harsen, farmaceutische producten, katalysatoren, insecticiden, antivriesmiddelen en van diverse fijnchemicaliën voor chemisch onderzoek. Verder wordt zwavelzuur toegepast bij een aantal industriële processen, zoals de raffinage van aardolie (5%) en bij het drogen van niet-basische gassen. 7% wordt toegepast bij het ontsluiten van metalen uit ertsen en 2% wordt gebruikt door de kleurstoffenindustrie om onder andere verven en inkten te maken.[37] De rest vindt toepassing bij de productie van explosieven, cellofaan, viscose, smeermiddelen en batterijen.[38]
Productie van kunstmest[bewerken | brontekst bewerken]
De zogenaamde 'natte methode' is de meest toegepaste methode voor de productie van fosforzuur en fosfaathoudende meststoffen met behulp van zwavelzuur. De grondstof voor kunstmest zijn fosfaatertsen, waarvan jaarlijks meer dan 100 miljoen ton verwerkt wordt. De belangrijkste component in deze ertsen is fluorapatiet (fluorhoudend calciumfosfaat). De behandeling hiervan met 93% zwavelzuur stelt naast calciumsulfaat en fosforzuur ook waterstoffluoride (HF) vrij:
Waterstoffluoride is erg corrosief (onder meer tegenover glas en andere silicaathoudende verbindingen) en wordt in een waterige oplossing gebracht om het gemakkelijker te kunnen verwerken.
Naast fluorapatiet kan ook gewoon apatiet (calciumfosfaat) gebruikt worden, dat door reactie met zwavelzuur omgezet wordt in calciumdiwaterstoffosfaat:
Dit wordt ingezet als superfosfaat, dat voor 18 tot 20% uit fosforpentoxide bestaat in de vorm van calcium-zuurfosfaat en voor de rest uit gips (calciumsulfaat), eveneens een reactieproduct van dit proces.
Naast de fosfaathoudende meststoffen is ook ammoniumsulfaat, een stikstofhoudende meststof, een belangrijke component in diverse meststofformuleringen. Ammoniumsulfaat kan eenvoudig bereid worden door ammoniak te borrelen door zwavelzuur:
Productie van sulfaatzouten[bewerken | brontekst bewerken]
Sulfaatzouten kunnen eenvoudig bereid worden door gebruik te maken van de sterk zure eigenschappen van het zwavelzuur: de reactie met metaalhoudende basen, zoals oxiden, sulfiden, hydroxiden of carbonaten, leidt tot vorming van sulfaatzouten. Deze zouten kennen toepassingen in verschillende industriële takken. Aluminiumsulfaat, dat in de papierindustrie gebruikt wordt om de papiervezels te laten coaguleren, kan bereid worden door bauxiet in contact te brengen met geconcentreerd zwavelzuur:
Koper(II)sulfaat wordt gebruikt in de tuinbouw als bestrijdingsmiddel tegen meeldauw. Het wordt op industriële schaal bereid uit koper(II)oxide of koper(II)sulfide.[39]
Een andere belangrijke stof is cerium(IV)sulfaat, dat sterk oxiderende eigenschappen bezit en als zodanig in industrie en onderzoek ingezet wordt. Dit zout wordt gesynthetiseerd uit cerium(IV)oxide:
Productie van zuren[bewerken | brontekst bewerken]
Door gebruik te maken van de sterk zure eigenschappen van zwavelzuur kunnen tal van zouten worden omgezet in zwakkere anorganische dan wel organische zuren. Onderstaande tabel geeft een overzicht van zouten en de corresponderende zuren die kunnen bereid worden:
| Zout | Zuur | Voorbeeldreactie met natriumzout |
|---|---|---|
| fluoriden | waterstoffluoride | |
| chloriden | waterstofchloride | |
| bromiden | waterstofbromide | |
| sulfiden | waterstofsulfide | |
| nitraten | salpeterzuur | |
| fosfaten | fosforzuur | |
| carboxylaten | carbonzuren |
Een aantal van deze reacties, zoals de productie van fosforzuur en salpeterzuur, wordt ook op commerciële schaal toegepast. Daarbij gebruikt men vaak bariumzouten als precursoren, omdat na reactie met zwavelzuur het onoplosbare bariumsulfaat neerslaat.
Waterstofjodide kan met deze methode niet bereid worden, omdat dit zuur ongeveer 100 miljoen keer sterker is dan zwavelzuur (op basis van de zuurconstanten van beide zuren). Bovendien wordt, indien uitgegaan wordt van een jodidezout als precursor, het jodide-ion te gemakkelijk geoxideerd tot di-jood, zelfs in verdund zwavelzuur. Waterstofbromide daarentegen kan wel bereid worden, maar dit gebeurt enkel op laboratoriumschaal en met verdund zwavelzuur. Hoewel waterstofbromide (met een pKa van −9) ongeveer 1 miljoen keer sterker is dan zwavelzuur is het mogelijk om het gevormde waterstofbromide, dat in evenwicht staat met zwavelzuur, over te destilleren en zo het evenwicht van de reactie in de richting van waterstofbromide te verschuiven:[40]
Het gebruik van verdund zwavelzuur is hierbij noodzakelijk, omdat anders oxidatie van het gevormde waterstofbromide tot dibroom optreedt:
Elektrolyt in batterijen[bewerken | brontekst bewerken]


Zwavelzuur fungeert als elektrolyt in een loodaccu, die onder andere in auto's wordt gebruikt. Een loodaccu is een oplaadbare galvanische cel waarbij lood aan de anode geoxideerd wordt:
De vrijgekomen elektronen stromen via een extern circuit naar de kathode, waar lood(IV)oxide gereduceerd wordt tot lood(II)sulfaat:
De globale reactie bij ontladen van de accu (met andere woorden: tijdens het verbruik van de elektrische stroom) toont aan dat zwavelzuur geconsumeerd wordt:
De reversibiliteit van alle reacties zorgt ervoor dat een accu oplaadbaar is. Bij het opladen van de loodaccu wordt het gevormde lood(II)sulfaat aldus opnieuw omgezet in lood en lood(IV)oxide.
Zwavel-jodiumcyclus[bewerken | brontekst bewerken]
De zwavel-jodiumcyclus is een thermochemisch proces om waterstofgas te bereiden, uitgaande van water, zwaveldioxide en di-jood. Bij de eerste reactie van het proces, de zogenaamde Bunsen-reactie, worden zwavelzuur en waterstofjodide gevormd:
In een volgende stap wordt zuurstofgas gevormd door het zwavelzuur bij hoge temperatuur (> 800 °C) te thermolyseren:
In een laatste stap wordt waterstofjodide omgezet in di-jood en waterstofgas bij een temperatuur van 320 °C.
Ook in de hybride zwavelcyclus wordt van een gelijkaardig proces gebruikgemaakt om waterstofgas te produceren.
Katalysator[bewerken | brontekst bewerken]
Zwavelzuur wordt toegepast als katalysator in diverse industriële processen. Zo is het een zure katalysator bij de omzetting van cyclohexanonoxime in caprolactam (de Beckmann-omlegging), dat de basis vormt voor de productie van nylon:
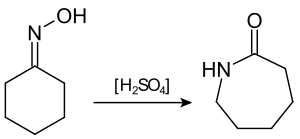
In de petrochemie wordt zwavelzuur aangewend voor de reactie tussen isobutaan en isobuteen, ter vorming van iso-octaan.
Droogmiddel[bewerken | brontekst bewerken]
De hygroscopische eigenschappen van zwavelzuur maken het mogelijk het zuur te gebruiken als droogmiddel, onder andere voor gassen. In de industrie worden natte gassen (gassen die een welbepaald gehalte aan stoom bevatten) door een bad met zwavelzuur geborreld om het water af te vangen. Ammoniak en andere basische of reactieve gassen kunnen echter niet gedroogd worden op zwavelzuur, vanwege reacties die ermee aangegaan kunnen worden.
Analytische chemie[bewerken | brontekst bewerken]
Zwavelzuur wordt in de analytische chemie gebruikt om standaardoplossingen te maken of om moeilijk oplosbare verbindingen (zoals metaalzouten of silicaten) in oplossing te krijgen. Hiertoe wordt ook (geconcentreerd) salpeterzuur aangewend.
Voorkomen op aarde[bewerken | brontekst bewerken]
Door de wateraantrekkende eigenschappen wordt zuiver (watervrij) zwavelzuur niet van nature op aarde aangetroffen. Verdund zwavelzuur komt wel voor op diverse plaatsen en kan een expliciete invloed op het milieu en de naburige ecologische systemen uitoefenen.


In de atmosfeer[bewerken | brontekst bewerken]
Zwavelzuur is een component van zure regen; zwaveldioxide wordt door zuurstofgas in de lucht geoxideerd, in aanwezigheid van water. Dit komt in wezen neer op de oxidatie van zwaveligzuur tot zwavelzuur:
Zwaveldioxide zelf ontstaat als voornaamste nevenproduct bij de verbranding van zwavelbevattende brandstoffen, zoals steenkool en aardolie. Tegenwoordig worden vrijwel alle aardgas en aardolie ontdaan van zwavel door middel van het Clausproces.
Vulkanische activiteit[bewerken | brontekst bewerken]
Daarnaast ontstaat zwaveldioxide ook als gevolg van vulkanische activiteit. Afzettingen van zuivere zwavel worden gevormd rondom fumarolen en solfataren. Fumarolen zijn openingen in de aardkorst, vaak in vulkanisch actieve gebieden, waaruit warme tot zeer hete gassen (zoals waterstofchloride, waterstofsulfide en koolstofdioxide) en dampen ontsnappen. Solfataren vormen een bijzonder type fumarole, waarbij de gassen sterk zwavelhoudend zijn (zwaveldioxide, waterstofsulfide en zwaveltrioxide).
Mineralogische processen[bewerken | brontekst bewerken]
Door oxidatie van sulfidehoudende mineralen, zoals pyriet (FeS2) of galeniet (PbS), ontstaat het sulfaation. Wanneer dit in contact komt met water, treedt protolyse op, met vorming van zwavelzuur. Het resulterende water is zeer zuur (bezit een lage pH) en wordt ook wel aangeduid met de Engelse termen acid mine drainage of acid rock drainage. Dit verzuurde water is in staat om diverse metalen uit gesteenten op te lossen, waardoor zware verontreiniging kan ontstaan. Het vrijzetten van zware metalen, zoals cadmium, barium, lood of kwik, kan door hun hoge giftigheid immers schadelijke gevolgen voor het milieu en de in het water levende organismen hebben.
Het volledige proces telt verschillende reactiestappen. Wanneer uitgegaan wordt van pyriet, treedt in een eerste stap oxidatie op tot sulfaat en wordt ijzer(II) vrijgesteld in oplossing:
IJzer(II) wordt door zuurstofgas gemakkelijk geoxideerd tot ijzer(III):
Het ijzer(III) slaat neer in waterig milieu als ijzer(III)hydroxide:
Echter, ijzer(III) kan zelf ook als oxidator voor pyriet optreden:
Deze reactie versnelt het volledige oplossingsproces, waardoor snelle verzuring van het oppervlakte- en grondwater optreedt.
Sulfaathoudende mineralen[bewerken | brontekst bewerken]
Naast zwavelzuur zelf komen op aarde ook diverse zouten van het zuur voor, die geclassificeerd worden als sulfaathoudende mineralen (mineraalklasse 7 binnen de classificatie van Strunz).[41] Sulfaathoudende mineralen komen hoofdzakelijk voor in hydrothermale aders. Deze aders zijn dunne zones (intrusies) in gesteenten waarin mineralen worden afgezet als gevolg van neerslagprocessen uit warm mineralenrijk water dat in de aardkorst circuleert. Daarnaast ontstaan ze in oxidatiegevoelige zones die rijk zijn aan sulfidehoudende mineralen.

Sulfaathoudende mineralen kunnen zowel in watervrije toestand voorkomen als in gehydrateerde toestand. Voorbeelden van watervrije sulfaathoudende mineralen zijn bariet (BaSO4) en anglesiet (PbSO4); zij hebben een vrij eenduidige samenstelling. Gehydrateerde sulfaathoudende mineralen zijn verscheidener van samenstelling, omdat er meerdere moleculen kristalwater in het kristalrooster kunnen worden opgenomen. Zo kan ijzer(II)sulfaat in de natuur voorkomen onder verschillende minerale vormen, afhankelijk van de hydratatiegraad:
- Szomolnokiet (FeSO4 · H2O)
- Rozeniet (FeSO4 · 4 H2O)
- Siderotiel (FeSO4 · 5 H2O)
- Ferrohexahydriet (FeSO4 · 6 H2O)
- Melanteriet (FeSO4 · 7 H2O)
Het zijn de sulfaathoudende mineralen die in de loop van de tijd onder de noemer vitriool werden geschaard en een niet onbelangrijke rol hebben gespeeld bij de ontdekking van zwavelzuur en de ontwikkeling van commercieel aantrekkelijke productiemethoden.
In de plantenwereld[bewerken | brontekst bewerken]
Zwavelzuur wordt als verdedigingsmiddel gebruikt door welbepaalde plantensoorten, hoewel dit fenomeen eerder uitzondering dan regel is. Zo heeft de algensoort Desmarestia munda zwavelzuur opgeslagen in zijn vacuolen, waardoor het kan vermijden opgegeten te worden door bepaalde zee-egels.[42]
Extraterrestrisch voorkomen[bewerken | brontekst bewerken]

Venus[bewerken | brontekst bewerken]
De atmosfeer van de planeet Venus bestaat hoofdzakelijk (ca. 96,5%) uit koolstofdioxide en is omgeven met een dikke laag wolken van zwavelzuur.[43] Het zwavelzuur ontstaat in hogere lagen van de atmosfeer door de inwerking van zonlicht op koolstofdioxide, zwaveldioxide en waterdamp. UV-fotonen met een golflengte van minder dan 169 nm dissociëren koolstofdioxide in koolstofmonoxide en atomair zuurstof. Dit zuurstofatoom is bijzonder reactief en reageert met zwaveldioxide tot zwaveltrioxide. Wanneer dit gas in contact komt met waterdamp, ontstaat zwavelzuur. Omdat de hogere lagen van de atmosfeer van Venus koel zijn, komt zwavelzuur voor in de vloeibare vorm. Het zuur vormt wolken die het zicht op het oppervlak van de planeet belemmeren.
Het zwavelzuur op Venus wordt via een cyclisch proces geregenereerd: de wolken produceren een soort zwavelzure regen. Bij het vallen worden de druppels opgewarmd, waardoor waterdamp ontsnapt en het zwavelzuur geconcentreerder wordt. Bij temperaturen boven 300 °C treedt ontleding op tot zwaveltrioxide en waterdamp (de gemiddelde dagtemperatuur op Venus bedraagt immers 480 °C). Het gevormde zwaveltrioxide is reactief en dissocieert tot zwaveldioxide en atomair zuurstof, dat de kleine hoeveelheden koolstofmonoxide oxideert tot koolstofdioxide. Zwaveldioxide en waterdamp stijgen op naar de hogere atmosfeer, alwaar ze opnieuw door fotochemische processen worden omgezet tot zwavelzuur.
Europa[bewerken | brontekst bewerken]
Door middel van infraroodspectra, opgemeten door de ruimtesonde Galileo op Europa, een maan van Jupiter, is aangetoond dat er mogelijk zwavelzuur (in gehydrateerde vorm) voorkomt. Omdat het zwavelzuur opgelost is in water, zorgt het voor een significante vriespuntsdaling, tot −63 °C. Dit zou een verklaring kunnen vormen voor het feit dat er vloeibaar water voorkomt onder de ijslaag die Europa bedekt.[44]
De interpretatie van de IR-spectra geeft aanleiding tot discussie, aangezien sommige astronomen van mening zijn dat de spectrale IR-absorpties afkomstig zijn van sulfaathoudende mineralen en niet van zwavelzuur zelf.[44]
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Lichamelijke blootstelling aan zwavelzuur[bewerken | brontekst bewerken]
Zwavelzuur is een sterk zuur, een krachtige oxidator en een wateronttrekkende stof: het werkt dus zowel irriterend als corrosief bij ieder contact met het lichaam. Contact met de huid kan leiden tot irritatie, roodheid, jeuk en in ernstiger gevallen brandwonden. Verder is het schadelijk voor de ogen: het veroorzaakt irritatie en prikkelt de traankanalen. Bij intens contact kan oogschade of zelfs blindheid optreden. Zwavelzuur is toxisch en inslikken ervan kan een fatale afloop hebben; een dergelijke vergiftiging wordt een zwavelzuurvergiftiging genoemd.[45]
De aerosol van zwavelzuur kan ademhalingsproblemen (geprikkelde luchtpijp, kortademigheid, hoesten en longoedeem) voortbrengen en corrosief werken op diverse weefsels van het lichaam, niet in het minst op de huid en de slijmvliezen. Ook erosie van het tandglazuur wordt waargenomen. Bij een acute blootstelling aan irriterende dampen met een hoge concentratie aan zwavelzuur kan het ziektebeeld RADS (Reactive Airways Dysfunction Syndrome) ontwikkeld worden, bij meerdere blootstellingen aan lagere concentraties de ziekte IIA (irritant-induced asthma).
Het International Agency for Research on Cancer (IARC), dat onderzoek doet naar de oorsprong van kanker, classificeert chemische stoffen op grond van hun carcinogeniteit. Het instituut heeft zwavelzuur ingedeeld in categorie 1, hetgeen impliceert dat zwavelzuur bij de mens kanker kan veroorzaken.[46] Dit doet zich voornamelijk voor bij personen die in de industrie direct of indirect in contact komen met dampen van zwavelzuur. Omdat de zeer fijne zwavelzuurdruppels in de lucht (met een diameter tot een paar micrometer) zich gemakkelijk kunnen afzetten op het weefsel van het ademhalingsstelsel, komen de tumoren hoofdzakelijk voor in de voorhoofdsholte, de longen en het strottenhoofd.
Chemische veiligheid[bewerken | brontekst bewerken]
Hoewel zwavelzuur op zich niet brandbaar of ontvlambaar is, kan het door zijn grote reactiviteit en incompatibiliteit met diverse materialen toch brand of zelfs explosies veroorzaken. Dit is het geval wanneer zwavelzuur of dampen van zwavelzuur in contact komen met basen, brandbare stoffen (zoals de meeste organische verbindingen), oxidatoren, reductoren en water. In contact met diverse metalen, zoals zink en magnesium, wordt waterstofgas gevormd, dat zeer licht ontvlambaar is. Bij het maken van verdunningen moet zwavelzuur steeds traag aan water worden toegevoegd en niet omgekeerd. Op die manier wordt vermeden dat de vloeistof opspat en eventuele lichamelijke letsels of schade aan andere materialen kan veroorzaken.
Explosieve mengsels worden gevormd wanneer zwavelzuur in contact komt met 4-nitrotolueen, perchloraten, waterstofperoxide (daarbij wordt een zogenaamde Piranha-oplossing gevormd), kwik(II)nitriet, kaliumchloraat en kaliumpermanganaat.
Bij verwarming worden irriterende of giftige dampen gevormd, waaronder zwaveltrioxide en zwaveldioxide. Dit kan een corrosieve aerosol veroorzaken, die diverse materialen, waaronder textiel en metalen, kan aantasten.
Opslag en transport[bewerken | brontekst bewerken]
Bij opslag dient men zwavelzuur strikt gescheiden te houden van brandbare, reducerende of sterk oxiderende stoffen, sterke basen, voeding en voedingsmiddelen. Opslag in vaten van roestvast staal of glazen flessen voldoet aan die eis. De opslagplaats heeft doorgaans een betonnen vloer die bestand is tegen corrosieve stoffen.
Als het gaat om grote hoeveelheden wordt zwavelzuur opgeslagen in tanks uit koolstofstaal, met een capaciteit tot 33 000 liter. Echter, na verloop van tijd kan het zwavelzuur ook staal aantasten, met vorming van waterstofgas enerzijds en ijzersulfaten anderzijds tot gevolg. Deze sulfaten kunnen een beschermende laag op de tankwanden vormen en voorkomen op die manier verdere aantasting, maar die zoutlaag is mechanisch gezien niet stabiel en kan makkelijk beschadigd worden.[47] De zouten komen dan terecht op de tankbodem en kunnen de kwaliteit van het zwavelzuur danig beïnvloeden. Bovendien leidt schade aan de zoutlaag tot verdere aantasting van het staal. Om dit te vermijden worden de stalen tanks aan de binnenzijde meestal gecoat met een fenolische harslaag. Een andere methode is de anodische bescherming van het ijzer.[48] Factoren die de schade aan het staal doen toenemen zijn verdunning van het zuur en een hogere temperatuur.[47] Daardoor moeten industriële tanks voorzien zijn van mechanismen die het insijpelen van vocht tegengaan. Verder moet verhitting vermeden worden en turbulente beweging van de vloeistof moet tot een minimum beperkt worden. In plaats van gewoon koolstofstaal worden de tanks en pijpleidingen ook wel uit roestvast staal (type RVS 317) gemaakt; dit staal bezit een hoog gehalte aan chroom, nikkel en koper en biedt voldoende weerstand tegen het corrosieve karakter van het zuur.
Zwavelzuur wordt voornamelijk getransporteerd met vrachtwagens en spoorwagons; dat laatste is economisch de gunstigste vervoersmethode. Voor het vervoer wordt het zwavelzuur naar tanks respectievelijk ketelwagens overgebracht, waarbij internationaal genormeerde procedures gevolgd moeten worden.[49] Ook de constructie van de tanks en ketelwagens is aan strenge veiligheidsnormen onderworpen. Bij het vervoer per spoor bevatten de ketelwagens 50 tot 100 ton zwavelzuur.[50]
Incidenten met zwavelzuur[bewerken | brontekst bewerken]
In het verleden hebben zich diverse incidenten met zwavelzuur voorgedaan:
- Op 22 november 1988 zonk nabij de plaats Herculaneum een schip, geladen met 1400 ton geconcentreerd zwavelzuur (93%), in de Mississippi. Er werden echter geen lekken in het schip vastgesteld. Om het schip te bergen, werd het zwavelzuur gedurende een periode van enkele maanden gecontroleerd geloosd in de rivier. Op die manier werd grote schade aan het aquatisch milieu voorkomen.
- In augustus 1995 kwam nabij een productiefaciliteit van DuPont in Kentucky in vier uur tijd meer dan 90 000 liter oleum vrij. Daarbij werd een chemische wolk gevormd, waardoor meer dan duizend inwoners moesten worden geëvacueerd. Verschillende personen hadden medische zorg nodig voor brandwonden aan ogen en luchtwegen. De oorzaak van het ongeval was toe te schrijven aan een slechte infrastructuur: voor de opslag van het zwavelzuur was gebruikgemaakt van een tank met pijpleidingen uit gietijzer, die het begaven als gevolg van corrosie.[51]
- In januari 2011 kapseisde op de Rijn tussen Mainz en Koblenz in de buurt van de Loreley de tanker Waldhof met 2400 ton zwavelzuur aan boord. Bij de Loreley maakt de Rijn een scherpe bocht en staat er een sterke stroming. Tijdens het overpompen van de vloeistof naar een ander schip raakte de Waldhof instabiel, verschoof en begon te verbuigen. Om die reden werd besloten het nog aanwezige zwavelzuur gecontroleerd te lozen in de Rijn.
- In juli 2012 liep op de Rijn tussen Oberwesel en Sankt Goar een tanker onder Nederlandse vlag met 1300 ton zwavelzuur aan boord aan de grond en blokkeerde de scheepvaart. Voordat het schip kon worden losgetrokken, moest een deel van de lading worden overgepompt. De tanker was onderweg van Ludwigshafen naar Antwerpen en raakte door onbekende oorzaak uit koers.
- In februari 2013 ontspoorde een goederentrein met zwavelzuur nabij een fabriek in de stad Revda in het Oeralgebied. Over het aantal ketelwagens dat gelekt heeft en de oppervlakte die daarbij vervuild raakte bestaat geen duidelijkheid. De cijfers variëren van twee tot vijftien wagens en van honderd tot duizend vierkante meter.[52]
- In december 2021 viel er een vat met 2000 liter zwavelzuur van een heftruck bij NXP te Nijmegen. Het ongeval was in de buitenlucht en is afgehandeld door de bedrijfsbrandweer.[bron?]
Literatuur[bewerken | brontekst bewerken]
- (en) M. King, M. Moats, W.G.I. Davenport & M.J. King (2006) – Sulfuric Acid Manufacture, uitgeverij Elsevier – ISBN 978-0080444284
Zie ook[bewerken | brontekst bewerken]
- Aanval met zuur
- John George Haigh, een moordenaar die zijn slachtoffers in zwavelzuur oploste
- Pyrozwavelzuur
- Sulfonzuur
- Sulfienzuur
- Thiozwavelzuur
- Zwaveligzuur
Externe links[bewerken | brontekst bewerken]
 zwavelzuur - International Chemical Safety Card
zwavelzuur - International Chemical Safety Card- (en) Gegevens van zwavelzuur in de GESTIS-stoffendatabank van het IFA
Bronnen
Voetnoten en referenties
|
| Dit artikel is op 30 november 2015 in deze versie opgenomen in de etalage. |




![{\displaystyle \mathrm {S\ {\xrightarrow[{\ \ oxidatie\ \ }]{+\ O}}\ SO_{2}\ {\xrightarrow[{\ \ oxidatie\ \ }]{+\ O}}\ SO_{3}\ {\xrightarrow[{\ \ hydratatie\ \ }]{+\ H_{2}O}}\ H_{2}SO_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb99c5c38f2ec7065d8ba3c8776df6c0ff31a539)














![{\displaystyle K_{ap}=\mathrm {[HSO_{4}^{-}][H_{3}SO_{4}^{+}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c77889ae8082ae1358bd33c637f6c5d3ec3d9c28)











































